Инструкция
1
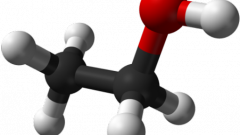
Этиловый спирт получают преимущественно как результат брожения сахаросодержащих продуктов, зерна, фруктов, ягод, овощей. Для этого используют ректификационные аппараты, нагревание, перегонку.
2
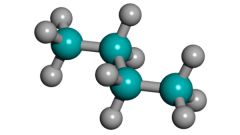
Получить этиловый спирт из этана простой реакцией можно в процессе каталитического окисления при нагревании до 2000 градусов в присутствии катализатора.
3
Другой способ получения этилового спирта из этана заключается в проведении следующих реакций:1. галогенирование при температуре 1000°С и в присутствии ультрафиолетового света:С2Н6 + Cl2 = C2H5Cl2. далее проведите реакцию с щелочью:С2H5Cl +NaOH = C2H5OH + NaCl
4
Этиловый спирт из этана можно получить и еще одним способом. Проведите дегидрирование этана при 400-5000°С в присутствии катализаторов платины Pt, никеля Ni, Al2O3:С2Н6 = С2Н4 + Н2
5
Далее в присутствии муравьиной кислоты НСООН или хлорной кислоты НclO4 полученный продукт смешайте с водой и нагрейте до температуры 85-1000°С, получая этиловый спирт:С2Н4 + Н2О = С2Н5ОН
6
7
В промышленности этан применяется для производства этилена - бесцветного газа, имеющего ту же химическую формулу, что и этан. В прошлом веке в сочетании с кислородом этилен применялся для наркоза. Сегодня этилен является сырьем для получения полиэтилена, винилацетата, окиси этилена, уксусной кислоты и многого другого. Этилен также является фитогормоном, влияющим на здоровье и рост многих живых организмов.





















C2H6 + Cl2 ––> C2H5Cl + HCl;
Ну а вторя реакция нормальная. Вы когда пишите статьи, обращайте внимание на содержание химических формул!