Инструкция
1
Из метана можно получить ряд сложных органических соединений. Сам он представляет собой бесцветный газ, не имеющий вкуса и запаха, практически нерастворимый в воде, и имеющий меньшую плотность, чем воздух. Он является одним из самых распространенных газов на Земле и других планетах Солнечной системы. При температуре свыше 1000оС метан разлагается до сажи и водорода: CH4→C+2H2.Этот процесс называется крекингом метана. При крекинге другого углеводорода - этана - получается этилен. Поэтому для получения этилена первоначально из метана получают этан, а затем этан подвергают крекингу.
2
С помощью реакции Вюрца можно получить из соединений метана этан, а затем начать процесс крекинга, в результате чего получится этилен. Эта реакция заключается в том, что к йодистому метилу добавляется металлический натрий, в результате чего получается этан: CH3-Y+[Na]+CH3-Y→C2H6Затем проводится реакция крекинга этана: C2H6→CH2=CH2+CH4+H2 (при t=500оС)
3
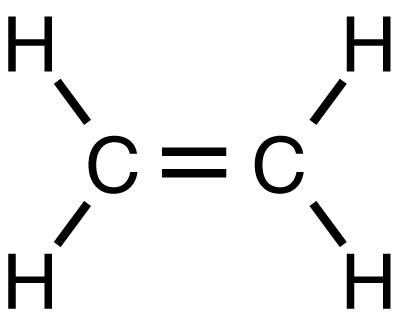
Существует и более современный и простой способ получения этилена из метана. В этом случае, реакцию обычно проводят при температуре 500-900оС в присутствии кислорода и оксидов марганца, кадмия. Затем газы разделяют абсорбцией, глубоким охлаждением и ректификацией под давлением. Уравнение получения этилена из метана выглядит следующим образом: 2CH4→C2H4+H2
4
Второй способ, ввиду его простоты, применяется чаще. Из этилена, в свою очередь, получают другие органические вещества, в том числе, полиэтилен, уксусную кислоту, этиловый спирт, винилацетат и стирол. В прошлом он также использовался в медицине для наркоза. Кроме того, этилен применяют для регуляции роста растений и созревания плодов. Также из него изготавливают синтетические смазочные масла, которые используются в промышленности и быту.