Инструкция
1
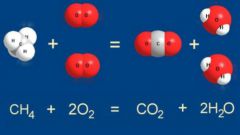
При уравнивании химической реакции важно не ошибиться в написании формулы. Для этого необходимо знать валентность элемента в том или ином соединении. Также необходим учет поведения элементов в специфических реакциях. Например, кислород имеет валентность равную двум, но в некоторых соединениях может проявлять высшую валентность. Если формула будет написана неправильно, то реакция может не уравняться.
2
После правильного написания получившихся формул расставляем коэффициенты. Они служат для уравнения элементов. Суть уравнивания заключается в том, чтобы число элементов до реакции равнялось числу элементов после реакции. Начинать уравнивание стоит всегда с металлов. Расставляем коэффициенты согласно индексам в формулах. Если с одной стороны реакции элемент имеет индекс два, а с другой не имеет (принимает значение единицы), то во втором случае перед формулой ставим двойку.
3
Как только перед веществом поставлен коэффициент, значения всех элементов в этом веществе увеличиваются в значение коэффициента. Если элемент обладает индексом, то сумма получившихся молекул будет равняться произведению индекса и коэффициента.
4
После уравнивания металлов переходим к неметаллам. Затем переходим к кислотным остаткам и гидроксильным группам. Далее уравниваем водород. В самом конце проверяем реакцию по уравненному кислороду.