Элемент калий и его обозначение
Калий - это химический элемент системы элементов, придуманной Дмитрием Менделеевым, который находится в первой группе. Он имеет атомный номер 19 и атомную массу равную 39,098 г/моль.
По своим физическим свойствам элемент представляет из себя металл серебристо-белого цвета. Он очень пластичный и плавкий. Имеет характерный металлический блеск. Калий легко режется ножом и по твердости не уступает куску твердого сыра.
Калий состоит из трех изотопов: 39К, 41К, 40К. Два первых соединения являются стабильными, а третий считается достаточно слабым, но при всем этом радиоактивным. Период полураспада последнего соединения составляет 1,32*109 лет.
Химический элемент в химии обозначают "К".
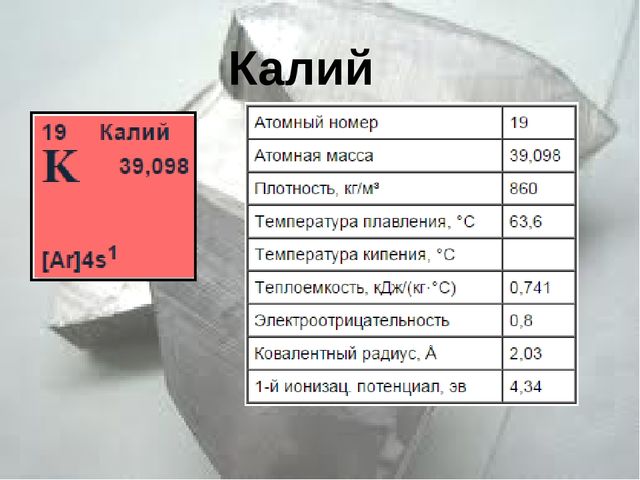 В нормальных условиях калий находится в твердом агрегатном состоянии. Температура плавления элемента равна 63 градуса, чего легко добиться при обычном нагревании. Температура же кипения элемента гораздо выше и составляет 761 градус.
В нормальных условиях калий находится в твердом агрегатном состоянии. Температура плавления элемента равна 63 градуса, чего легко добиться при обычном нагревании. Температура же кипения элемента гораздо выше и составляет 761 градус.
Строение калия и его физико-химические свойства
Химический элемент располагается в четвертом периоде, поэтому все его электроны будут расположены на четырех энергетических уровнях. Энергетическая формула элемента выглядит следующим образом: +19К: 2ё; 8ё; 8ё; 1ё.
Графическая формула элемента выглядит соответствующим образом.
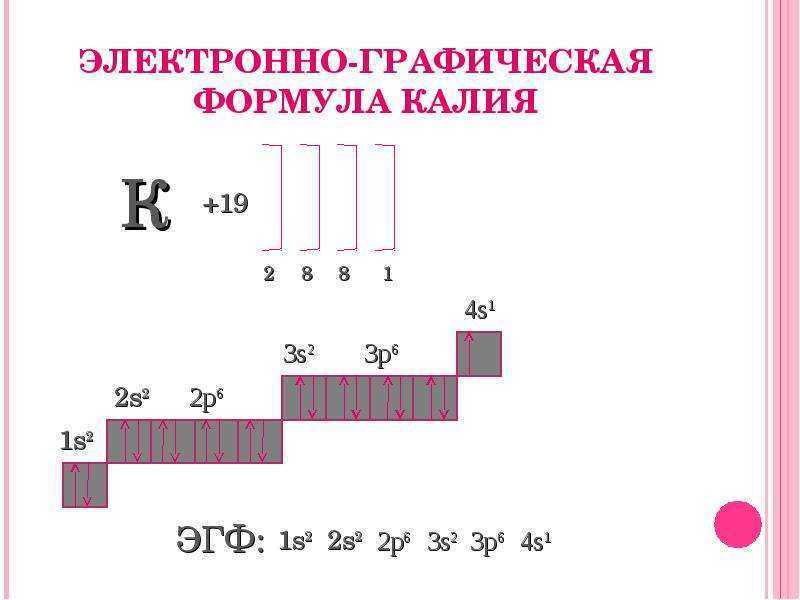
Исходя из электронного строения элемента, можно сделать вывод, что калий имеет валентность равную I. Так как в химических реакциях элемент отдает один электрон с внешнего энергетического уровня, он проявляет восстановительные свойства, приобретая степень окисления +1.
Благодаря своему расположению в таблице Менделеева, можно сказать, что восстанавливающие свойства калия выражены гораздо сильнее, чем у Na, но слабее, чем у Rb. Такая закономерность связана с увеличением атомного диаметра. Кроме этого, калий будет сильнее, чем атом кальция, так как на внешнем энергетическом уровне у кальция уже два электрона и оторвать их гораздо сложнее, чем один.
Калий по своей химической структуре является простым веществом с металлической кристаллической решеткой и металлической химической связью. Исходя их этого, можно сказать, что калий легко вступает в реакцию и очень быстро окисляется на воздухе.
Реакции с простыми веществами
Как уже было сказано, калий очень активный элемент, поэтому очень легко вступает в реакцию с окружающеми его веществами. Если оставить кусок калия на воздухе, он мновенно вступит в реакцию с воздухом.
Элемент прекрасно реагирует с кислородом, азотом, фосфором и галогенами.
Реакция окисления
Взаимодействие любых элементов с кислородом (О2) называется окислением. В результате реакции образуется оксид калия (II). В результате процесса образуется промежуточное соединение оксиген калия.

Горение
Если поджечь калий или его соединения, можно наблюдать фиолетовый цвет пламени у горелки или лучины. Благодаря этому, такая реакция является качественной на определение калия.

Реакция галогенирования
Исходя из того, с каким из элементов вступает в реакцию калий, реакции были названы: йодирование, фторирование, хлорирование и бромирование. Эти реакции являются реакциями присоединения, так как в результате образуется одно соединение. Соответственно, результатом химической реакции будут хлориды, бромиды, йодиды и фториды.
Реакция с азотом и фосфором
Калий реагирует с N2 на открытом воздухе. В результате горения образуется нитрид калия, который представляет собой соединение темно-зеленого цвета.
По такой же схеме калий взаимодействует с фосфором.
Реакция с водородом
В качестве еще одного примера реакции присоединения можно привести реакцию калия с водородом. В результате химического взаимодействия образуется гидрид калия.
Взаимодействие с комплексными соединениями
Калий способен реагировать с кислотами, солями, основаниями и оксидами. С каждым из перечисленных соединений калий вступает в реакцию по разному.
Реакция с водой
Если поместить кусочек калия в воду можно отметить бурную химическую реакцию. Калий, в буквальном смысле слова, будет провоцировать процесс кипения. В результате реакции образуется щелочь и чистый водород.

Реакция с кислотой
Взаимодействие с кислотами в данном случае можно назвать реакцией замещения, так как калий замещает атомы гидрогена из их соединений. В качестве примера можно привести реакцию калия с соляной кислотой. По такому же принципу калий реагирует с другими неорганическими кислотами.
Реакция с оксидами
Эта реакция относится к реакции обмена. Если металл в составе оксида оказывается слабее, чем калий, то элемент вытесняет его из соединения, присоединяя кислород.
Реакция с основаниями
Реакция с основаниями происходит по тому же принципу, что и взаимодействие с оксидами. Калий способен реагировать с соединениями, в которых элемент слабее, чем он сам. В результате данной реакции барий выпадает в осадок.

Реакция с солями
Химическая реакция с солями позволяет получать чистые металлы без примесей. Калий как сильный восстановитель вытесняет более слабый металл, присоединяя остаток соли к себе.
Взаимодействие с органическими соединениями
Характерной реакцией взаимодействия калия с такими соединениями является реакция с жирами. Калий вытесняет один из атомов гидрогена, образуя стеарат, пальмитат или другое соединение и водород.
Где используют калий
Как и любой металл, калий очень востребован в промышленной индустрии. Благодаря своим сильным восстановительным свойствам и высокой реактивности его используют в следующих сферах:
- в качестве реагента в химической промышленности;
- сплавы с большим содержанием элемента используют для разработки ядерных реакторов;
- цианид калия используют на рудниках. Там он используется в качестве химического реактива для вытеснения драгоценных металлов из руды.
- является основой для производства удобрений;
- средняя соль калия и угольной кислоты используется в производстве стекла. Его активно используют для выдувания хрусталя, и производства высокоточной оптики.
- калий является одной из составляющих чистящих веществ и стиральных средств;
- хлорат калия используют для изготовления спичек;
- калия хлорид используется в пищевой промышленности в качестве эмульгатора;
- стеарат данного элемента применяется в мыловарении. Он является основой для изготовления жидкого мыла.

Роль калия для организма человека
Как уже было сказано, калий постоянно находится в непосредственной близости от человека. Будь то мыло, соль или обычный стиральный порошок. Однако, надо сказать, что калий играет незаменимую роль не только в жизни человека, но в нормальном функционировании его организма.
Калий принимает участие в передаче между нейронами импульса, тем самым регулируя нервную проводимость клеток. Совместно с ионами Na, данный элемент периодической системы регулирует водно-солевой обмен всех биологических жидкостей человека.
Гипокалиемия очень быстро дает о себе знать. Характерными симптомами дефицита калия являются:
- избыточная отечность;
- повышенная раздражительность;
- нарушение памяти;
- заторможенность реакций;
- повышает вероятность возникновения инфарктов и инсультов.
Однако, не только недостаток калия может спровоцировать негативные последствия для организма. Его избыток также губительно действует на человека. На фоне высокой концентрации калия в организме может развиваться эрозии на стенках тонкого кишечника.
Для того, чтобы контролировать уровень калия в своем организме, необходимо знать, в каких продуктах он содержится в больших количествах. К ним можно отнести:
- орехи (кедровые орехи, лесные, фундук, кешью);
- морская капуста;
- фрукты (мандарины, сладкие яблоки, дыни, арбузы, бананы)
- гречневая и перловая крупа;
- картофель;
- лук и чеснок.
- куриные яйца;
- молочные продукты (молоко, сыр, сливки, сметана).

Суточная норма потребления калия составляет 3-5 грамм для взрослого человека.