Атомы образуют молекулу при помощи разных типов связи. Они отличаются между собой направленностью и энергией, с помощью которых можно эту связь образовать.
Ковалентная связь образуется при помощи валентных электронов. При сближении двух атомов наблюдается перекрытие электронных облаков. При этом электроны каждого атома начинают двигаться в области, принадлежащей другому атому. В пространстве, окружающем их, появляется избыточный отрицательный потенциал, который стягивает положительно заряженные ядра. Это возможно только при условии, что спины общих электронов антипараллельны (направлены в разные стороны).
Ковалентная связь характеризуется довольно большим значением энергии связи на каждый атом (около 5 эВ). Это означает, что необходимо 10 эВ, чтобы молекула из двух атомов, образованная ковалентной связью, распалась. Атомы могут приблизиться друг к другу на строго определенное состояние. При таком сближении наблюдается перекрытие электронных облаков. Принцип Паули гласит, что вокруг одного и того же атома не может вращаться два электрона в одинаковом состоянии. Чем больше наблюдается перекрытие, тем более отталкиваются атомы.
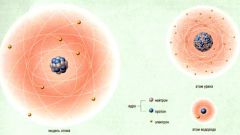
Это частный случай ковалентной связи. Ее образуют два атома водорода. Именно на примере этого химического элемента в двадцатых годах прошлого века был показан механизм образования ковалентной связи. Атом водорода очень прост в своем строении, что позволило ученым относительно точно решить уравнение Шредингера.
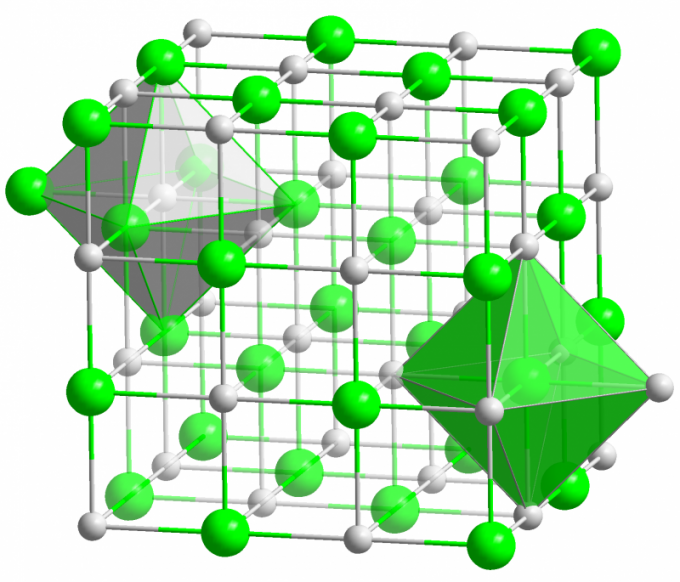
Кристалл всем известной поваренной соли образуется при помощи ионной связи. Она возникает, когда атомы, образующие молекулу, обладают большой разницей в электроотрицательности. Менее электроотрицательный атом (в случае кристалла поваренной соли это натрий) отдает все свои валентные электроны хлору, превращаясь в положительно заряженный ион. Хлор, в свою очередь, становится отрицательно заряженным ионом. Эти ионы связаны в структуре электростатическим взаимодействием, которое характеризуется довольно большой силой. Вот почему ионная связь обладает наибольшей прочностью (10 эВ на атом, что в два раза больше, чем энергия ковалентной связи).
В ионных кристаллах очень редко наблюдаются дефекты различного рода. Электростатическое взаимодействие прочно удерживает положительные и отрицательные ионы в определенных местах, не давая появиться вакансии, междоузелью и другим дефектам кристаллической решетки.
Квантовомеханическая модель ковалентной связи
Ковалентная связь образуется при помощи валентных электронов. При сближении двух атомов наблюдается перекрытие электронных облаков. При этом электроны каждого атома начинают двигаться в области, принадлежащей другому атому. В пространстве, окружающем их, появляется избыточный отрицательный потенциал, который стягивает положительно заряженные ядра. Это возможно только при условии, что спины общих электронов антипараллельны (направлены в разные стороны).
Ковалентная связь характеризуется довольно большим значением энергии связи на каждый атом (около 5 эВ). Это означает, что необходимо 10 эВ, чтобы молекула из двух атомов, образованная ковалентной связью, распалась. Атомы могут приблизиться друг к другу на строго определенное состояние. При таком сближении наблюдается перекрытие электронных облаков. Принцип Паули гласит, что вокруг одного и того же атома не может вращаться два электрона в одинаковом состоянии. Чем больше наблюдается перекрытие, тем более отталкиваются атомы.
Водородная связь
Это частный случай ковалентной связи. Ее образуют два атома водорода. Именно на примере этого химического элемента в двадцатых годах прошлого века был показан механизм образования ковалентной связи. Атом водорода очень прост в своем строении, что позволило ученым относительно точно решить уравнение Шредингера.
Ионная связь
Кристалл всем известной поваренной соли образуется при помощи ионной связи. Она возникает, когда атомы, образующие молекулу, обладают большой разницей в электроотрицательности. Менее электроотрицательный атом (в случае кристалла поваренной соли это натрий) отдает все свои валентные электроны хлору, превращаясь в положительно заряженный ион. Хлор, в свою очередь, становится отрицательно заряженным ионом. Эти ионы связаны в структуре электростатическим взаимодействием, которое характеризуется довольно большой силой. Вот почему ионная связь обладает наибольшей прочностью (10 эВ на атом, что в два раза больше, чем энергия ковалентной связи).
В ионных кристаллах очень редко наблюдаются дефекты различного рода. Электростатическое взаимодействие прочно удерживает положительные и отрицательные ионы в определенных местах, не давая появиться вакансии, междоузелью и другим дефектам кристаллической решетки.
Видео по теме