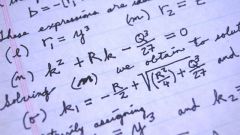Инструкция
1
Массовая доля вещества находится по формуле: w = m(в)/m(см), где w – массовая доля вещества, m(в) – масса вещества, m(см) – масса смеси. Если же вещество растворено, то формула выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже можно найти: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю можно умножить на 100%.
2
Если в условии задачи не дано значения массы, то его можно рассчитать с помощью нескольких формул, выбрать нужную помогут величины данные в условии. Первая формула для нахождения массы: m = V*p, где m – масса, V – объем, p – плотность. Следующая формула выглядит так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярная масса в свою очередь складывается из атомных масс элементов, входящих в состав вещества.
3
Для лучшего понимания данного материала решим задачу. Смесь медных и магниевых опилок массой 1,5 г обработали избытком серной кислоты. В результате реакции выделился водород объемом 0,56 л (нормальные условия). Вычислите массовую долю меди в смеси.
В этой задаче проходит реакция, записываем ее уравнение. Из двух веществ с избытком соляной кислоты взаимодействует только магний: Mg + 2HCl = MgCl2 + H2. Чтобы найти массовую долю меди в смеси, необходимо подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, найдем массу меди: m(Cu) = m(см) – m(Mg). Ищем массу магния: m(Mg) = n(Mg)*M(Mg). Найти количество вещества магния поможет уравнение реакции. Находим количество вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(H2) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная масса магния равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 или 60%.
В этой задаче проходит реакция, записываем ее уравнение. Из двух веществ с избытком соляной кислоты взаимодействует только магний: Mg + 2HCl = MgCl2 + H2. Чтобы найти массовую долю меди в смеси, необходимо подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, найдем массу меди: m(Cu) = m(см) – m(Mg). Ищем массу магния: m(Mg) = n(Mg)*M(Mg). Найти количество вещества магния поможет уравнение реакции. Находим количество вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(H2) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная масса магния равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 или 60%.
Видео по теме
Обратите внимание
Массовая доля не может быть больше единицы или, если она выражается в процентах, больше 100%.
Источники:
- "Пособие по химии", Г.П. Хомченко, 2005.
- Вычисление доли продаж по региону