Инструкция
1
Для упрощения решения представьте, что атом имеет шарообразную форму. То есть его внешний электрон вращается вокруг ядра по круговой орбите (что в реальности бывает далеко не всегда).
2
Затем возьмите Таблицу Менделеева, чтобы определить молярную массу элемента, радиус атома которого нас интересует. Обозначьте ее буквой m, к примеру. Вспомните, что молярная масса выражается в граммах на моль, то есть указывает, сколько граммов вещества содержится в одном его моле.
3
Потом вам надо вспомнить само определение моля и его связь с универсальным числом Авогадро, которое приблизительно равно 6,022*10 в степени 23. Иными словами, та самая молярная масса m, определенная по Таблице Менделеева, содержит 6,022*10 в степени 23 атомов этого вещества.
4
После чего вам необходимо узнать его плотность. Для этого воспользуйтесь любым химическим или техническим справочником. Обозначьте плотность буквой ρ, например. А для чего вам надо было узнавать этот параметр? Зная плотность ρ, зная молярную массу m, вы в одно действие найдете, какой объем v занимает один моль этого вещества по следующей формуле v=m/ρ.
5
Ну, а для чего вам надо знать объем, занимаемый одним молем вещества? Зная, в каком объеме содержится то самое число Авогадро атомов этого вещества, вы без малейшего труда посчитаете, какой объем занимает один атом (имеющий строго шарообразную форму). Иными словами, объем одного атома равен m/6,022*10 в степени 23ρ.
6
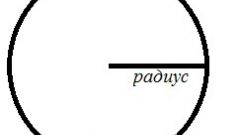
Учитывая, что формула объема шара - 4πRв степени 3/3, вы без малейшего труда вычислите, чему равен этот самый радиус. Преобразуя равенство, вы получите следующее решение:
R в степени 3 = 3m/4πρх6,022*10 в степени 23
R в степени 3 = 3m/4πρх6,022*10 в степени 23
7
Извлеките из полученного результата кубический корень, и вот он – искомый радиус атома!