Вам понадобится
- Учебник по химии, лист бумаги, карандаш.
Инструкция
1
Загляните в школьный учебник по химии восьмого или девятого класса, открыв его на параграфе о скорости протекания химических реакций. Для того чтобы понимать, как можно повлиять на данную скорость, нужно определить для себя само понятие скорости в данном контексте. Итак, скорость протекания химической реакции определяется по изменению количества вещества, участвующего в ней, или по изменению продукта какой-либо реакции, вычисленные в расчете на единицу времени и на единицу объема. Данное определение соответствует гомогенной реакции. В случае же гетерогенной реакции расчет осуществляется на единицу поверхности раздела фаз.
2
Обратите внимание, что скорость протекания химической реакции бывает как средняя, так и мгновенная. Соответственно, влиять можно как на одну, так и на другую скорость.
3
Заметьте также, что скорость химической реакции зависит от природы самого реагирующего вещества. Основными же факторами, оказывающими влияние на скорость протекания химической реакции, являются изменение температуры, присутствие катализаторов и изменение концентрации реагентов.
4
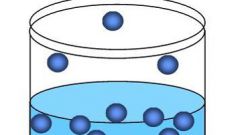
Обратите внимание на механизм влияния изменения концентрации веществ на скорость протекания химической реакции. Суть данного эффекта заключается в том, что число столкновений частиц реагирующих веществ напрямую зависит от концентрации данных частиц. Увеличивая количество частиц, можно увеличить и скорость химической реакции. Данная зависимость отражена в законе действующих масс.
5
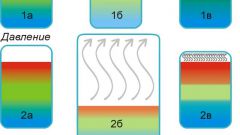
Задумайтесь над механизмом увеличения скорости протекания химической реакции посредством увеличения температуры. Дело в том, что данный фактор является самым часто используемым наряду с применением катализаторов. Причем применять его можно для большинства химических реакций. Эффект, производимый данным фактором, вычисляется по правилу Вант-Гоффа. Данный закон гласит, что повышение температуры на 10оС увеличивает скорость протекания химической реакции в три-четыре раза.
6
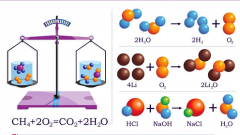
Не забывайте, что все вышеприведённые способы изменения скорости протекания химической реакции не влияют на саму природу и механизм реакции и не изменяют химический состав реагентов, кроме способа по применению катализаторов. Катализаторы, которые также часто используются в целях повышения скорости, хоть и не расходуются в результате протекания реакции, но содержатся в составе промежуточных продуктов реакции. Также известно, что катализаторы уменьшают полную энергию активации процесса, что связано с тем, что каталитический процесс идет по особому пути, образуя особые промежуточные частицы.