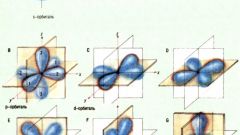
Совокупность чисел, которые характеризуют состояние электрона, называются квантовыми числами. Волновую функцию электрона в атоме, его уникальное состояние определяют четыре квантовых числа – главное, магнитное, орбитальное и сплин – магнитный момент движения элементарной частицы, выраженный в количественном значении. Главное квантовое число имеет обозначение n .Если главное квантовое число увеличивается, то соответственно увеличивается и орбита, и энергия электрона. Чем меньше значение n, тем больше значение энергетического взаимодействия электрона с ядром. Если суммарная энергия электронов является минимальной, то такое состояние атома называется невозбужденным или основным. Состояние атома с высоким значением энергии называется возбужденным. На энергетическом уровне самое большое число электронов можно определить формулой N = 2n2.Когда случается переход электрона с одного энергетического уровня на другой, изменяется и главное квантовое число.В квантовой теории принято утверждение, что энергия электрона квантуется, то есть может принимать лишь дискретные, определенные значения. Чтобы знать состояние электрона в атоме необходимо учитывать энергию электрона, форму электронного облака и других параметров. Из области натуральных чисел, где n может быть равно 1 и 2, и 3 и так далее, главное квантовое число может принимать какое угодно значение. В квантовой теории энергетические уровни обозначают буквами, значение n - числами. Номер периода, где находится элемент, равен числу энергетических уровней в атоме, находящемся в основном состоянии. Все энергетические уровни состоят из подуровней. Подуровень состоит из атомных орбиталей, которые определяются, характеризуются главным квантовым числом n, орбитальным числом l и квантовым числом ml. Число подуровней каждого уровня не превышает значение n.Волновое уравнение Шредингера является самым удобным описанием электронного строения атома.
Что такое главное квантовое число
Главное квантовое число - это целое число, которое является определением состояния электрона на энергетическом уровне. Энергетический уровень – это набор стационарных состояний электрона в атоме с близкими значениями энергии. Главное квантовое число определяет удаленность электрона от ядра, и характеризует энергию электронов, которые этот уровень занимают.

Совет полезен?
Добавить комментарий к статье