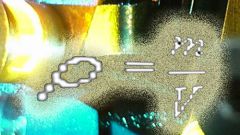Инструкция
1
Перед вами стоит следующая задача: сколько литров водорода понадобится, чтобы провести гидрирование 20-и литров этилена? То есть, чтобы осуществить реакцию: С2Н4 + Н2 = С2Н6. Сделайте вывод: и этилен, и водород – газы. Исходя из уравнения реакции и закона Авогадро вы увидите, что объемы прореагировавших газов в данном случае пропорциональны их количествам. Следовательно, требуемый объем водорода такой же, как и объем этилена, и равен двадцати литрам.
2
Или: определите какой объем водорода выделится при взаимодействии 2,23 граммов натрия с избытком соляной кислоты? Вы видите, что кислота взята в избытке, значит, реакция прошла до конца, то есть было израсходовано все количество натрия, с образованием соли – хлорида натрия – и вытеснением водорода. Запишите уравнение реакции следующим образом: 2Na + 2HCl = 2NaCl + H2
3
Исходя из коэффициентов, а также из того, что 2,23 грамма натрия составляют 0,1 моля этого вещества, сделайте вывод: выделилось 0,05 моля водорода. Поскольку, согласно закону Авогадро, при нормальных условиях один моль газа занимает 22,4 литра, получите ответ:22,4 * 0,05 = 1,12 литра
4
Найдите объем, занимаемый водородом, зная его массу. Тут вам на помощь придет универсальное уравнение Менделеева – Клапейрона, описывающее состояние идеального газа. Разумеется, водород не является идеальным газом, но при температурах и давлениях, не слишком отличающихся от нормальных, это уравнение используйте в расчетах. Запишите его следующим образом:PVm = MRT
5
Путем элементарного преобразования, вы получите нужную формулу: V = MRT/Pm, где M – известная нам масса водорода, R – универсальная газовая постоянная, Т – температура в градусах Кельвина, Р – давление в паскалях, m – молярная масса водорода.
6
Подставляя в формулу известные вам величины, получите искомый результат.
Видео по теме