Вам понадобится
- атомный номер элемента, N-Z диаграмма.
Инструкция
1
Нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Это и представляет основную сложность при определении числа нейтронов - атомный номер элемента или его электронная оболочка не дают однозначного ответа на этот вопрос. Например, в ядре атома углерода всегда содержится 6 протонов, однако протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с разным количеством нейтронов в ядре называются изотопами этого элемента. Изотопы могут быть природными, а могут быть и получены искусственно.
2
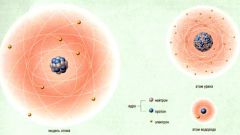
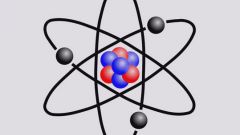
Ядра атомов обозначают буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A - это массовое число атома. A = Z+N, где Z - заряд ядра (число протонов), а N - число нейтронов. Нижнее число - это Z - заряд ядра. Такая запись дает информацию о количестве нейтронов в ядре. Очевидно, что оно равно N = A-Z.
3
У разных изотопов одного химического элемента число A меняется, что можно увидеть в записи этого изотопа. Определенные изотопы имеют свои оригинальные названия. Например, обычное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2, цифра 2 сверху, 1 снизу), а изотоп тритий - два нейтрона (A = 3, цифра 3 сверху, 1 снизу).
4
Зависимость числа нейтронов от числа протонов отражена на так называемой N-Z диаграмме атомных ядер. Устойчивость ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов наиболее устойчивы при N/Z = 1, то есть при равенстве количества нейтронов и протонов. С ростом массового числа область устойчивости сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для наиболее тяжелых ядер.
Видео по теме
Источники:
- Строение атомного ядра
- как найти количество нейтронов