Инструкция
1
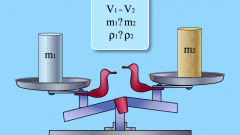
Во-первых, исходя из универсального определения плотности – количество вещества в единице объема. В том случае, если чистый водород находится в герметичном сосуде, плотность газа определяется элементарно, по формуле (М1 – М2)/V, где М1 – общая масса сосуда с газом, М2 – масса пустого сосуда, а V – внутренний объем сосуда.
2
Если же требуется определить плотность водорода, имея такие исходные данные, как его температура и давление, тут на помощь приходит универсальное уравнение состояния идеального газа, или уравнение Менделеева – Клапейрона: PV = (mRT)/M.
P – давление газа
V – его объем
R – универсальная газовая постоянная
Т – температура газа в градусах Кельвина
M – молярная масса газа
m – фактическая масса газа.
P – давление газа
V – его объем
R – универсальная газовая постоянная
Т – температура газа в градусах Кельвина
M – молярная масса газа
m – фактическая масса газа.
3
Идеальным газом считается такая математическая модель газа, в которой потенциальной энергией взаимодействия молекул по сравнению с их кинетической энергией можно пренебречь. В модели идеального газа между молекулами не действуют силы притяжения или отталкивания, а соударения частиц с другими частицами или стенками сосуда, абсолютно упруги.
4
Разумеется, ни водород, ни другой газ не является идеальным, но эта модель позволяет проводить вычисления с достаточно высокой точностью при условиях, близких к атмосферному давлению и комнатной температуре. Например, дана задача: найти плотность водорода при давлении 6 атмосфер и температуре 20 градусов по Цельсию.
5
Сначала переведите все исходные величины в систему СИ (6 атмосфер = 607950 Па, 20 градусов Ц=293 градуса К). Затем напишите уравнение Менделеева-Клапейрона PV = (mRT)/M. Преобразуйте его в виде: P = (mRT)/MV. Поскольку m/V есть плотность (отношение массы вещества к его объему), то получаете: плотность водорода = PM/RT, причем все необходимые данные для решения у нас есть. Вы знаеете величину давления (607950), температуру (293), универсальную газовую постоянную (8,31), молярную массу водорода (0,002).
6
Подставив эти данные в формулу, вы получите: плотность водорода при заданных условиях давления и температуры равна 0,499 кг/кубический метр, или примерно 0,5.
Источники:
- как найти плотность водорода