Инструкция
1
В окислительно-восстановительных реакциях одни элементы выступают как доноры электронов, т.е. окисляются; другие - как акцепторы, т.е. восстанавливаются.
2
В случаях взаимодействия типичных окислителей и восстановителей вы можете сразу определить, что речь идет об окислительно-восстановительной реакции. Например, это взаимодействие щелочных металлов с кислотами или галогенами, процессы горения в кислороде.
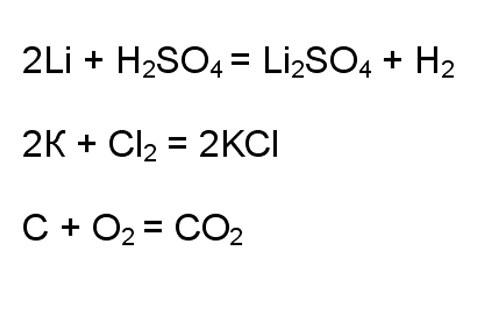
3
Рассмотрите более сложный случай на примере реакции перманганата калия с сульфитом калия в присутствии большого количества щелочи КОН. Чтобы убедиться, что данная реакция окислительно-восстановительная, определите степени окисления элементов в правой и левой части. Атомы одних элементов всегда принимают или отдают одинаковое количество электронов. В этой реакции это кислород, водород, калий. У других степень окисления может быть разной, как у марганца и серы.
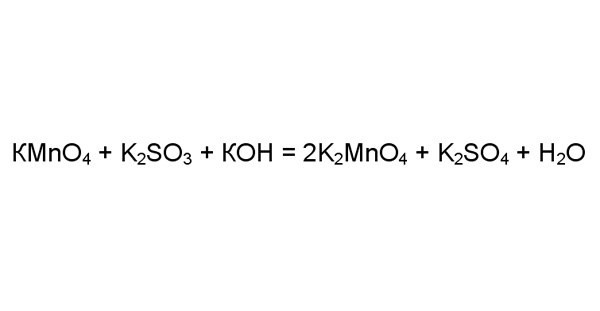
4
Определите степень окисления марганца и серы в левой части уравнения. Возьмите перманганат калия: кислород всегда является акцептором электронов степенью окисления (-2). Четыре атома кислорода присоединяют 8 электронов. Калий – донор электронов, его степень окисления (+1). Один атом калия отдает один электрон. Тогда марганец должен отдать: 8-1=7 электронов.
5
Аналогично определяете, что степень окисления серы в сульфиде калия (+4). Три атома кислорода забирают 6 электронов, а два атома калия отдают два электрона.
6
Теперь найдите степени окисления для этих элементов в правой части. В манганате калия K2MnO4 четыре атома кислорода присоединяют восемь электронов, а два атома калия отдают два. Значит, марганец уменьшил степень окисления с (+7) на (+6), т.е. восстановился.
7
Сера в сульфате калия, наоборот, окислилась с (+4) до (+6). В молекуле K2SO4 четыре атома кислорода принимают восемь электрона, а два атома калия отдают два. Следовательно, шесть электронов отнимаются у атома серы.
8
Степени окисления марганца и серы поменялись. И вы можете сделать вывод, что данная реакция окислительно-восстановительная.




