Вам понадобится
- - таблица растворимости солей, кислот, оснований.
Инструкция
1
Прежде чем приступать к написанию ионных уравнений, необходимо усвоить некоторые правила. Нерастворимые в воде, газообразные и малодиссоциирующие вещества (например, вода) на ионы не распадаются, а значит, записывайте их в молекулярном виде. Также сюда относятся слабые электролиты, такие как H2S, H2CO3, H2SO3, NH4OH. Растворимость соединений можно узнать по таблице растворимости, которая является разрешенным справочным материалом на всех видах контроля. Там же указаны все заряды, которые присущи катионам и анионам. Для полноценного выполнения задания необходимо написать молекулярное, ионное полное и ионное сокращенное уравнения.
2
Пример № 1. Напишите реакцию нейтрализации между серной кислотой и гидроксидом калия, рассмотрите ее с точки зрения ТЭД (теории электролитической диссоциации). Сначала запишите уравнение реакции в молекулярном виде и расставьте коэффициенты.H2SO4 + 2KOH = K2SO4 + 2H2OПроанализируйте полученные вещества на их растворимость и диссоциацию. Все соединения растворимы в воде, а значит диссоциируют на ионы. Исключение только вода, которая на ионы не распадается, следовательно, останется в молекулярном виде.Напишите ионное полное уравнение, найдите одинаковые ионы в левой и правой части и подчеркните. Чтобы сократить одинаковые ионы, зачеркните их.2H+ +SO4 2- +2K+ +2OH- = 2K+ +SO4 2- + 2H2OВ результате получится ионное сокращенное уравнение:2H+ +2OH- = 2H2OКоэффициенты в виде двоек также можно сократить:H+ +OH- = H2O
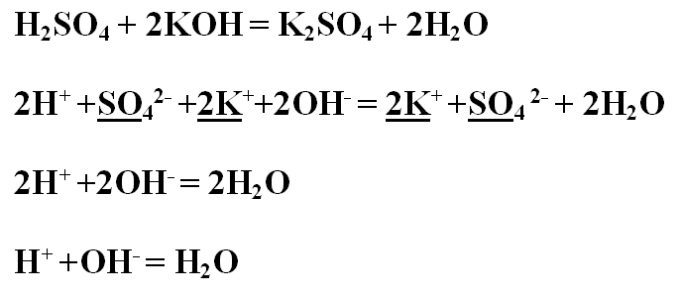
3
Пример № 2. Напишите реакцию обмена между хлоридом меди и гидроксидом натрия, рассмотрите ее с точки зрения ТЭД. Запишите уравнение реакции в молекулярном виде и расставьте коэффициенты. В результате, образовавшийся гидроксид меди выпал в осадок голубого цвета. CuCl2 + 2NaOH = Cu(OH) 2↓ +2NaClПроанализируйте все вещества на их растворимость в воде – растворимы все, кроме гидроксида меди, который на ионы диссоциировать не будет. Запишите ионное полное уравнение, подчеркните и сократите одинаковые ионы:Cu2+ +2Cl- + 2Na+ +2OH- = Cu(OH) 2↓+2Na+ +2Cl-Остается ионное сокращенное уравнение:Cu2+ +2OH- = Cu(OH) 2↓
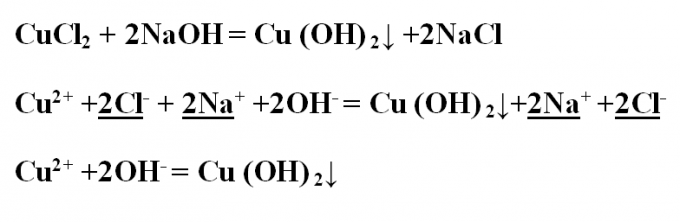
4
Пример № 3. Напишите реакцию обмена между карбонатом натрия и соляной кислотой, рассмотрите ее с точки зрения ТЭД. Запишите уравнение реакции в молекулярном виде и расставьте коэффициенты. В результате реакции образуется хлорид натрия и выделяется газообразное вещество СО2 (углекислый газ или оксид углерода (IV)). Оно образуется за счет разложения слабой угольной кислоты, распадающейся на оксид и воду. Na2CO3 + 2HCl = 2NaCl + CO2↑+H2OПроанализируйте все вещества на их растворимость в воде и диссоциацию. Углекислый газ уходит из системы, как газообразное соединение, вода – это малодиссоциирующее вещество. Все остальные вещества на ионы распадаются. Запишите ионное полное уравнение, подчеркните и сократите одинаковые ионы:2Na+ +СO3 2- +2H+ +2Cl- =2Na+ +2Cl- +CO2↑+H2OОстается ионное сокращенное уравнение:СO3 2- +2H+ =CO2↑+H2O
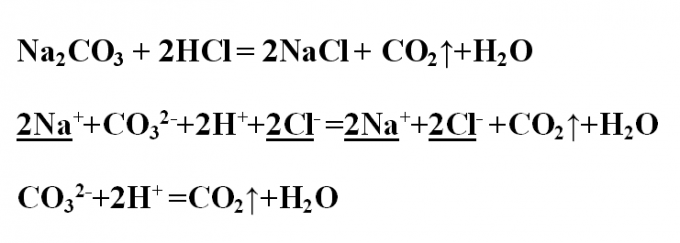
Видео по теме
Обратите внимание
Чтобы правильно определить количество ионов, нужно коэффициент, стоящий перед формулой, умножить на индекс.
Полезный совет
В уравнениях реакций обязательно проверяйте коэффициенты.
Источники:
- как составить уравнения на реакции ионного обмена