Инструкция
1
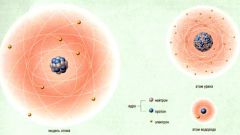
Как известно из начального курса химии, количество вещества (n) измеряется в молях и определяет количество структурных единиц вещества (электронов, протонов, атомов, молекул, и т.д.), содержащихся в заданной массе (или объеме).
2
Эту физическую величину удобно использовать при описании химических реакций, поскольку молекулы взаимодействуют в количестве кратном целому числу, не зависимо от их массы (коэффициенты в химических уравнениях отражают соотношение между количествами веществ, вступивших в реакцию).
3
Учитывая, что в реальных опытах количество молекул (атомов) вещества слишком большое, его неудобно применять в вычислениях. Вместо этого принято выражать число молекул в молях.
4
Т.о. количество вещества в одном моле численно равно постоянной Авогадро (NA = 6,022 141 79(30)×1023 моль−1). При округлении получим NA = 6,02.1023
5
Уникальность этой постоянной в том, что если число молекул N = NA, то их вес в а.е.м. (атомных единицах массы) численно равен их весу в граммах. Иными словами, чтобы перевести а.е.м. в граммы, нужно просто умножить их на NA.
6,02.1023 *а.е.м. = 1 г
6,02.1023 *а.е.м. = 1 г
6
Такие порции молекул (атомов) вещества называются молем вещества. Значит, моль – это мера количества вещества. 1 моль равен 6,02.1023 структурных частиц данного вещества.
7
Масса одного моля вещества называется молярной массой (M). Молярная масса определяется умножением молекулярной массы вещества на постоянную Авогадро (NA).
8
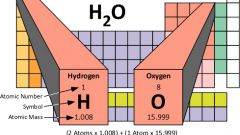
Молекулярная масса находится путем сложения атомной массы всех атомов, входящих в состав молекулы данного вещества. Например, для молекул воды (H2O) она составит: 1*2+16=18 гмоль.
9
Итак, количество вещества вычисляют по формуле: n = mM, где m – масса вещества.
Число молекул определяется: N = NA*n, а для газов: V = Vm *n, где Vm – молярный объем газа, равный 22,4 лмоль (при нормальных условиях).
Число молекул определяется: N = NA*n, а для газов: V = Vm *n, где Vm – молярный объем газа, равный 22,4 лмоль (при нормальных условиях).
10
Получаем общее соотношение:
n = mM = NNA = VVm
n = mM = NNA = VVm
Видео по теме
Источники:
- как вычислить количество вещества