Вам понадобится
- - наименование вещества;
- - таблица Менделеева.
Инструкция
1
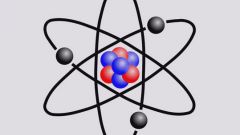
Главное квантовое число принимает целые значения: n = 1, 2, 3, … . Если n=∞, это подразумевает, что электрону сообщена энергия ионизации – энергия, достаточная для его отделения от ядра.
2
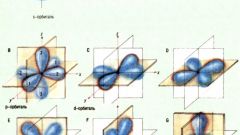
В пределах одного уровня электроны могут отличаться подуровнями. Такие различия в энергетическом состоянии электронов одного уровня отражаются побочным квантовым числом l (орбитальным). Оно может принимать значения от 0 до (n-1). Значения l обычно символически представлены буквами. От значения побочного квантового числа зависит форма электронного облака.
3
Движение электрона по замкнутой траектории провоцирует появление магнитного поля. Состояние электрона, обусловленное магнитным моментом, характеризуется магнитным квантовым числом m(l). Это третье квантовое число электрона. Оно характеризует его ориентацию в пространстве магнитного поля и принимает диапазон значений от (-l) до (+l).
4
В 1925 году ученые предположили наличие у электрона спина. Под спином понимают собственный момент импульса электрона, не связанный с его движением в пространстве. Спиновое число m(s) может принимать только два значения: +1/2 и -1/2.
5
Согласно принципу Паули, в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел. Хотя бы одно из них должно различаться. Так, если электрон находится на первой орбите, для него главное квантовое число n=1. Тогда однозначно l=0, m(l)=0, а для m(s) возможны два варианта: m(s)=+1/2, m(s)=-1/2. Именно поэтому на первом энергетическом уровне может находиться не более двух электронов, и имеют они разное спиновое число.
6
На второй орбитали главное квантовое число n=2. Побочное квантовое число принимает два значения: l=0, l=1. Магнитное квантовое число m(l)=0 для l=0 и принимает значения (+1), 0 и (-1) для l=1. Для каждого из вариантов существует еще по два спиновых числа. Итак, максимально возможное число электронов, находящихся на втором энергетическом уровне, равно 8.
7
К примеру, у благородного газа неона полностью заполнены электронами два энергетических уровня. Общее число электронов неона равняется 10 (2 с первого уровня и 8 со второго). Этот газ инертный, не вступает в реакции с другими веществами. Другие вещества, вступая в химические реакции, стремятся приобрести структуру благородных газов.
Полезный совет
Чтобы полностью объяснить строение электронных оболочек атомов для всех случаев, кроме принципа Паули, нужно знать еще принцип наименьшей энергии и правило Гунда.
Источники:
- «Начала химии», Н.Е. Кузьменко, В.В. Еремин, В.А. Попков, 2008.